Peso Atómico
Es el número de electrones que tiene cierto compuesto químico.
Regla del Octeto
La regla del octeto dice que, la tendencia de los átomos de los elementos del sistema periódico, es completar sus últimos niveles de energía con una cantidad de electrones tal que adquiere una configuración semejante a la de un gas noble, ubicados al extremo derecho de la tabla periódica y son inertes, o sea que es muy difícil que reaccionen con algún otro elemento pese a que son elementos electroquímicamente estables, ya que cumplen con la ley de Lewis, ó regla del octeto. Esta regla es aplicable para la creación de enlaces entre los átomos.
Electrovalencia
Configuración Electrónica de los Elementos Químicos
la configuración electrónica es el modo en el cual los electrones están ordenados en un átomo.
Tabla periódica de Mendeleiev
La tabla periódica de los elementos fue propuesta por Dimitri Mendeleiev y Julius Lothar Meyer quienes, trabajando por separado, prepararon una ordenación de todos los 64 elementos conocidos, basándose en la variación computacional de las propiedades químicas (Mendeleiev) y físicas (Meyer) con la variación de sus masas atómicas. A diferencia de lo que había supuesto Newlands, en
Grupo 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII Periodo 1 1
H2
He2 3
Li4
Be5
B6
C7
N8
O9
F10
Ne3 11
Na12
Mg13
Al14
Si15
P16
S17
Cl18
Ar4 19
K20
Ca21
Sc22
Ti23
V24
Cr25
Mn26
Fe27
Co28
Ni29
Cu30
Zn31
Ga32
Ge33
As34
Se35
Br36
Kr5 37
Rb38
Sr39
Y40
Zr41
Nb42
Mo43
Tc44
Ru45
Rh46
Pd47
Ag48
Cd49
In50
Sn51
Sb52
Te53
I54
Xe6 55
Cs56
Ba* 72
Hf73
Ta74
W75
Re76
Os77
Ir78
Pt79
Au80
Hg81
Tl82
Pb83
Bi84
Po85
At86
Rn7 87
Fr88
Ra** 104
Rf105
Db106
Sg107
Bh108
Hs109
Mt110
Ds111
Rg112
Uub113
Uut114
Uuq115
Uup116
Uuh117
Uus118
UuoLantánidos * 57
La58
Ce59
Pr60
Nd61
Pm62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
LuActínidos ** 89
Ac90
Th91
Pa92
U93
Np94
Pu95
Am96
Cm97
Bk98
Cf99
Es100
Fm101
Md102
No103
Laur
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles |
Grupos A las columnas verticales de
Los grupos de
Grupo 1 (IA): los metales alcalinos
Grupo 2 (IIA): los metales alcalinotérreos
Grupo 3 al Grupo 12: los metales de transición , metales nobles y metales mansos
Grupo 13 (IIIA): Térreos
Grupo 14 (IVA): carbonoideos
Grupo 15 (VA): nitrogenoideos
Grupo 16 (VIA): los calcógenos o anfígenos
Grupo 17 (VIIA): los halógenos
Grupo 18 (Grupo VIII): los gases nobles
Períodos de la tabla periódica
Las filas horizontales de
La tabla periódica consta de siete períodos:
Aplicaciones
La agrupación de los elementos en la tabla periódica hace que resalten sus propiedades y características. Por ejemplo, al ganar electrones los elementos aumentan en electronegatividad y lo hacen los elementos que están a la derecha y hacia arriba de la tabla periódica. Así, flúor es el elemento más electronegativo de la tabla periódica. La reactividad de los elementos aumenta al aumentar los períodos, haciendo que helio sea el elemento más inerte de la tabla periódica.
Las diferencias en energía de ionización también se pueden visualizar en la tabla periódica, aumentando con incrementos en el número atómico de los elementos. Así, los elementos del grupo 1 tienen la energía de ionización más baja y los gases nobles, la más alta.
Los elementos del grupo 1 son los más metálicos de la tabla periódica disminuyendo esta propiedad al aumentar el grupo hacia la derecha de la tabla.

Enlaces Químicos
Es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeto.
Tipos de enlace
El enlace entre dos átomos nunca se corresponde exactamente con una de las siguientes categorías. Sin embargo, son útiles para clasificar muchas de las propiedades y reactividad química de una gran variedad de compuestos.
 | ||
Enlace sencillo | Enlace doble | Enlace triple |
Los enlaces covalentes entre átomos de carbono se diferencian por su fortaleza, su longitud y su geometría.
La fortaleza de un enlace se mide por la cantidad de energía que es necesario para suministrar y romperlo.
La longitud de un enlace es la distancia que separa los dos centros de los átomos que están unidos.
La geometría es la orientación de las moléculas en el espacio.
Clases de Cadenas Carbonadas
--C=C--C=C--- |
Tipos de Enlace
a) Cadenas Carbonadas Saturadas
Son aquellas cuyos átomos de carbono están unidos por enlaces simples.
b) Cadenas Carbonadas No Saturadas
Considerando la forma de la cadena
Son aquellas cuyos átomos de carbono están unidos por enlaces terciarios.
Cadenas Abiertas o Acíclico
a) Lineal

b) Ramificada
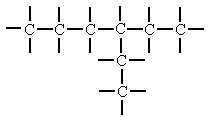
Cadenas Cerradas o Cíclica
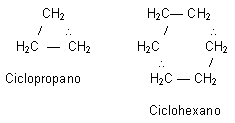
CH4 | Fórmula desarrollada o estructurada | Ubicación en el espacio de los átomos. | |
--C -- | H3C – CH3 C2H6 | Fórmula semidesarrollada o semiestructurada. | Tipos de Enlace que unen a los átomos de carbono. |
H – H2C = C – CH3 C3H6 | Fórmula Global, General o Empírica | Número de átomos de cada uno de los elementos químicos que forman la molécula |
Carbono Primario.- El máximo número de hidrógenos con que se puede combinar un carbono es de 4.
Carbono Secundario.- Son los carbonos que tienen 2 valencias saturadas por hidrogeno.
Carbono Terciario.- Son aquellos que solo tienen saturadas por hidrogeno.
Carbono Cuaternario.- Son los carbonos que forman todos sus en laces con átomos de carbono o con otros radicales no con hidrogeno.
1) Hidrocarburos
Compuestos binarios formados por Hidrógeno y Carbono.
H3C – CH3 ----> C2H6
H2C = CH2 ----> C2H4
HC == CH ----> C2H2
C – C – C – C – CH3 H3 H2 H2 H2 | C – C = C – C – CH3 H3 H H H2 | H3 C – C – C =- C – C H3 H2 |
C5H12 | C5H10 | C5H8 |
Clases de Hidrocarburos
Alcanos ( - ) CnH2n + 2 C10H22
Alquenos ( = ) CnH2n C10H20
Alquinos ( =- ) CnH2n - 2 C10H18
C7H? (3=) ---> C7H10
C7H? (3=-) ---> C7H4
# Carbonos | Prefijo | Sufijo |
1 | MET | ANO ENO INO |
2 | ET | |
3 | PROP | |
4 | BUT | |
5 | PENT | |
6 | EX | |
7 | HEPT | |
8 | OCT | |
9 | NON | |
10 | DEC |
2) Oxigenadas
3) Nitrogenadas
No hay comentarios:
Publicar un comentario